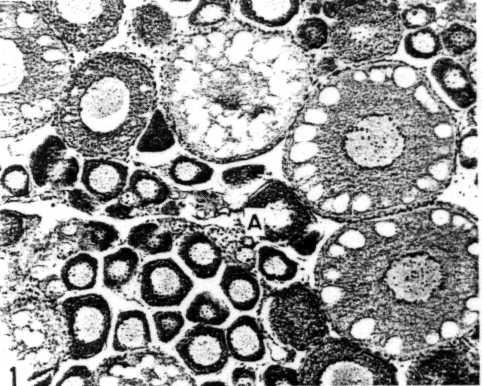

Figura 2: Tejidos gonadales de los experimentos de reversión de sexo: 1) Tejido femenino. 2) Ovotestis: tejido masculino y femenino. 3) Gónada masculina.
·Producción de neomachos·
Se puede revertir el sexo de hembras de trucha arco iris para producir machos XX utilizando dos esteroides: 17 a -metiltestosterona (MT) y 11 b -hidroxiandrostenediona (OHA). El objetivo es determinar las condiciones más propicias para transformar peces hembras en machos. Esta técnica tiene un indudable interés económico. Los machos de la trucha arcoiris se desarrollan más despacio que las hembras. Cuando llegan al peso de mercado ya son demasiado viejos y su aspecto es menos apetecible para el consumidor. Su comercialización es menos rentable. Desde hace algún tiempo se conocen técnicas de transformación del sexo en estas especies de peces. Se puede lograr mediante choques térmicos u hormonales. Sin embargo, la legislación impide la comercialización para consumo humano de animales que hayan sufrido tratamientos hormonales. Existe una técnica que soluciona estos problemas. El objetivo es conseguir que todos los animales sean hembras. Para esto se cruzan hembras normales con neomachos. Los neomachos son genéticamente hembras que han sido tratadas hormonalmente para transformarlas en machos. Las células madre de sus testículos sólo tienen dotación cromosómica XX, por tanto únicamente producen espermatozoides X, que al cruzarlos con óvulos (X), generan toda la descendencia XX: hembras. La descendencia no han sufrido ningún tratamiento hormonal y, por tanto, se pueden comercializar. Este procedimiento tiene como ventaja que cuando se logra criar una población de neomachos su semen puede ser congelado para utilizarlo en inseminación durante generaciones.
 |
 |
 |
|
Figura 2: Tejidos gonadales de los experimentos de reversión de sexo: 1) Tejido femenino. 2) Ovotestis: tejido masculino y femenino. 3) Gónada masculina. |
||
El procedimiento de masculinización suele emplear el andrógeno sintético MT. Los peces se alimentan con 3 mg / Kg de dieta durante los primeros 60 días. Esto produce poblaciones con el 100% de machos en los que la mayoría de animales pierden o tienen incompletos los espermiductos y el semen debe ser extraído quirúrgicamente. El tratamiento de poblaciones de peces normales con MT también necesita esperar hasta que los animales sean adultos para determinar mediante experimentos de crianza o de morfología gonadal cuales son los machos XX. El uso de peces manipulados cromosómicamente para ser todos hembras (ginogenéticos) asegura que todos los animales sean machos XX con el sexo revertido (neomachos).
|
|
|
|
Figura 1: Gónadas de machos XX a los 2 años de edad que han sido generados por una inversión simple en 17 a -metiltestosteona. (A) La gónada superior es un ovario normal con un una pequeña cantidad de tejido testicular en el extremo anterior. Las dos del medio son de peces intersexo con tejido testicular y ovárico. La inferior es un ovario completo. (B) Varios grados de formación testicular. El superior y el del medio son testículos poco desarrollados pero que todavía contienen espermiductos intactos. El inferior es un testículo con 2/3 del tamaño gonadal normal. |
|
También se puede logr ar una reversión del sexo sumergiendo el pez en esteroides durante el desarrollo temprano. Puede conseguirse con una única inversión aplicada en las cercanías del momento de eclosión. La efectividad del método es del 90-100%.
La masculinización por inversión normalmente hace uso de MT. Sin embargo, el esteroide natural OHA produce una masculinización transitoria de la trucha arcoiris (Oncorhynchus mukiss), cuando se sumerge o se le da de comer. La ingesta de OHA tiene un efecto masculinizante más duradero, que en algunos casos puede llegar a ser permanente.
Freist et al. (1995) 1 hicieron un estudio para determinar cuando puede ser revertido el sexo de un grupo ginogenético de trucha arcoiris manteniendo los espermatozoides intactos usando MT o OHA. Buscaron también cuando el pez es sensible a la masculinización y si son capaces de producir una descendencia 100% femenina. Veremos a continuación cómo lo hicieron:
Para realizar el experimento utilizaron huevos de 19 hembras y semen de 5 machos. Para la obtención de hembras ginogenéticas utilizaron el método de Thorgaard et al (1983) 2 . Consiste en irradiar semen con luz ultravioleta para inactivar el esperma. Este esperma pierde su contenido genético pero es capaz de inducir la formación de un embrión a partir del óvulo. Para ampliar el protocolo de gimnogénesis en tencas se puede consultar Geldhauser (1995) 3 . Este encontró las condiciones óptimas para provocarla en irradiación del esperma con 100 KRAd y tratamiento por choque térmico durante 30 minutos a 4ºC, 5 minutos después de la inseminación.
La mitad de los huevos fertilizados sufrieron un choque térmico a 29 ºC durante 10 minutos. Los alevines crecieron normalmente, entre 11,5 y 13,5 ºC.
Estos 2 grupos fueron sometidos a los 2 esteroides: MT (el grupo de choque térmico a 29ºC) y OHA (ambos). Se aplicaron una sola vez o variasveces, tanto por inversión como por ingestión en las semanas próximas al momento de alumbramiento. La inversión se produjo por el método de Goetz, et al. (1979) 4 en una concentración final de 400 mg de esteroide/litro durante 2 horas. La alimentación de los peces hormonados contenía 3 mg/Kg de sustancia activa y fue administrada durante 8 semanas. El sexo de los peces se determinó a los 174 días de la fecundación examinando la morfología gonadal de algunos individuos. A los 2 años se comprobó la madurez gonadal por presión abdominal (Figura 1). El semen de los machos que lo producían fue conservado por criopreservación, siguiendo el método de Wheeler y Thorgaard (1991) 5 . Este consiste en añadirle un crioprotector, congelarlo en hielo seco y almacenarlo en N2 líquido. Tabat y Mizuta (1997) 6 estudiaron un método de criopreservación en semen de hirame (un lenguado japonés) concluyendo que la eficiencia del esperma congelado es similar a la del fresco.
Para evaluar la supervivencia se contaron el nº de descendientes que alcanzaron los 6 meses de vida. El sexado de estos se hizo bajo el microscopio de disección (Figura 2). Los resultados del cambio de sexo fueron comparados estadísticamente mediante la prueba de Chi-cuadrado.
Como resultado de su procedimiento de gimnogénesis obtuvieron un 100% de hembras con el choque térmico a 26-29 ºC con un porcentaje de supervivencia muy bajo. Los protocolos de reversión del sexo produjeron diferentes grados de masculinización. La MT fue efectiva en grupos a los que se administró por inversión o mediante una combinación de inversión más alimentación. Las inversiones múltiples en MT son menos eficientes que una inversión una semana después del momento de eclosión de los huevos. La “inversión y alimentación” produce casi el 100% de machos. El OHA no funciona por inversión solamente, pero es efectivo cuando se combina “inversión y alimentación”. Los peces que se sumergieron en MT o que se “sumergieron y comieron” OHA tiende a tener un alto porcentaje de machos funcionales (con los espermiductos intactos), mientras que los que se “sumergieron y comieron” MT no. En los sumergidos en OHA se obtuvo poca reversión del sexo. El porcentaje de supervivencia, comparado con sus controles varió entre el 0 y el 62%. 21 de 23 machos XX produjo toda su descendencia femenina.
En el trabajo se ha descrito un método de producción de poblaciones 100% femeninas a partir del cruce de madres normales con neomachos. Los neomachos fueron generados por reversión del sexo de poblaciones homogéneas de hembras obtenidas mediante manipulación cromosómica. El uso del semen congelado de los neomachos permite evitar el problema de las elevadas mortalidades registradas cuando las poblaciones 100% hembra se generan por manipulación cromosómica. Esta técnica es simple y económicamente rentable. Si se emplea OHA para generar los neomachos se tienen menores problemas de comercialización que cuando se emplean esteroides sintéticos (Es un esteroide natural). El esperma de peces cuyo sexo ha sido gimnogenéticamente revertido puede generar poblaciones completamente femeninas durante años. La inversión e ingestión en OHA produce una masculinización permanente, sin embargo, desconocen el modo en que ocurre; ambos tratamientos por separado producen una masculinización transitoria. Mediante la ingestión de 0,5 mg/Kg de MT durante 60 días obtuvieron un 82% de individuos con espermiductos funcionales.
2 de los 23 neomachos producen descendencia masculina. Creen que esto es debido a que el cromosoma Y no queda completamente desactivado durante la radiación del esperma con luz UV. Este problema apenas tiene repercusión económica porque se puede eliminar el lote de esperma congelado en el que se detecte.
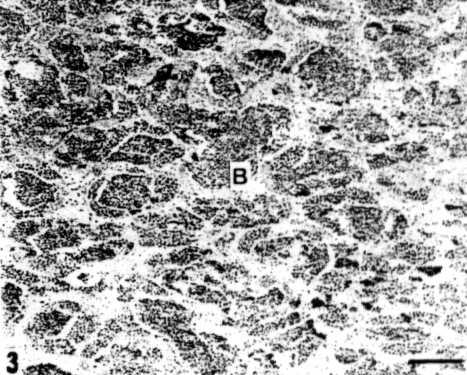
El método de masculinización con MT fue realizado satisfactoriamente en carpas utilizando 0.12 g/Kg, durante 40 días por Linhart et al (1989) 7. Los mismos autores no obtuvieron resultados satisfactorios en tenca con MT. Nagy et al. (1981) 8 lograron un 100% de masculinización en carpas gimnogenéticas. Lishart et al. (1995) 9 encontraron que en tenca el método de reversión de sexo más efectivo era la alimentación con MT en dosis de 0,102 g/Kg 40 o 60 días después de la activación. Sin embrago, su producción de hembras gimnogenéticas se encontraba con una elevadísima mortalidad (98,7-100%) (figura 3). El motivo para ello es la pobre calidad del agua y el acoso de los parásitos. Recomiendan utilizar alimento de la máxima calidad y tomar medidas de higiene. La formalina que usan normalmente en la desinfección de los baños es tóxica para los individuos gimnogenéticos.
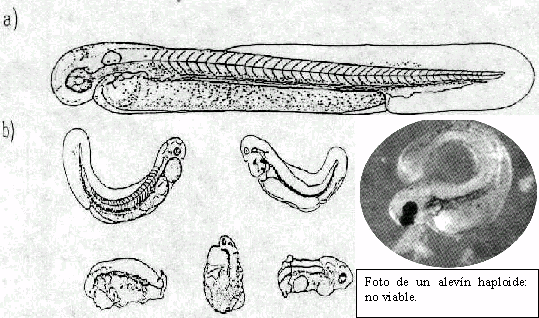
Figura 3: Esquema
de alevines de tenca manipulada gimnogenéticamente recién
eclosionados. A) Alevín diploide viable. B) Alevines haploides: anormales,
no viables. Al lado se muestra una foto de uno de ellos.
Abreviaturas:
MT = 17 a -metiltestosterona
OHA = 11 b -hidroxiandrostenediona
Bibliografía:
Este trabajo está basado en el publicado por Feistet et al. (1995) 1.
1 Feist G., Yeoh C., Fitzpatick M. S. y Schreck C. B. (1995). The production of functional sex-reversed male rainbow trout with 17 a-methyltestosterone and 11 b-hidroxiandrostenedione. Aquaculture.131:145-152
2 Thorgaard, G. H., Allendorg, F. W. y Knudsen, K. L. (1983). Gene centromere mapping in rainbow trout: high interference over long map distances. Genetics, 103: 771-783
3 Geldhauser f. (1995). Gymnogénesis in tench (Tinca tinca (L.)). Pols. arch. Hydrobiol. 42 (1-2):141-146
4 Goetz, F.W., Donaldson, E. M., Hunter, G. A. y Dye, H. M. (1979). Effects of stradiol-17 b y a-methyltestosterone on gonadal diferentiation in the coho salmon, Oncorhynchus kisutch. Acuaculture, 17, 267-278
5 Wheeler, P. A. y Thorgaard, G. H. (1991). Cryopreservation of rainbow trout semen in large straws. Aquaculture. 93: 95-100
6 Tabata K. y Mizuta A. (1997). Cryopreservation of sex reversed gynogenetic female sperm in hirame. Fisheries Science. 63(3): 482-483
7 Linhart O., Slechtoáp V., Kvasni?ka P., Ráb P. y P?ikpyl I. (1989). Cromosome manipulations in tench (Tinca tinca L.) and Carp (Cyprinus caripio. L.) in czechoslovakia. Práce Vúrh Vod?hay. 18: 53-60
8 Nagy A., Bercsényi M. y Csányi V. (1981). Sex-reversal in carp (Cyprinus carpio) by oral administration of methylterosterone. Can. J. Fish Aquat. Sci. 38:725-728
9 Linhart O., Kvasni? ha P., Flajšhans M., Kasal A., Ráb P., Pale ?ek J., Šlechta V., Hama ?vá J. y Prokeš M. (1995). Genetic studies with tench, Tinca tinca L.: induced meiotic gymnogénesis and sex reversal, Aquaculture.132: 239-251